とうやく382号(2008年5月号)学術欄HOME > 学術欄 |
|

動植物がつくりだした 1 はじめに
筆者は来年3月に長い間お世話になった本学を定年退職します。このような時に東薬会から学術欄への寄稿を依頼されましたので、東薬会広報委員会のご了解をいただき、筆者が行ってきた天然物探索にかかわる研究のいくつかを、卒業生の皆様に紹介させていただくことにしました。
2 アラグステロール類(不運なステロイド)
筆者の研究の中で上記目的の(1)に最も接近した天然物は、海洋動物から見出したアラグステロール類と思っています。この研究は1990年代の前半に山田先生の化学教室で行われました。
沖縄県新城島(あらぐすくじま)近海のサンゴ礁で採集したXestospongia属海綿の成分を探索したところ、数種の新規な構造のステロイドが得られました。 
図1 Xestospongia属海綿の写真 (沖縄県新城島近海にて採取した試料の船上写真) 発見した新規天然物に名前をつけるのは発見者の特権であり、また楽しみでもあります。通常は起源生物の学名に由来する命名を行いますが、Xestospongiaの名前にちなんで命名された天然物は山ほど報告されていたので、紛らわしさを避けるために、採集地の新城島(あらぐすくじま)の名称を用いてアラグステロール(aragusterol)と命名しました。それらの化学構造はNMR(核磁気共鳴分光法)を中心とした機器分析、化学変換およびX線結晶解析を用いて特異な側鎖をもつ構造を明らかにすることができました。 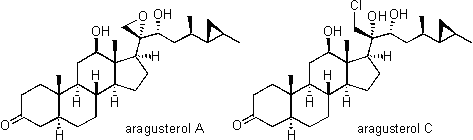 アラグステロール類の生物活性については、さる製薬会社との共同研究として進められました。まず細胞レベル(in vitro)での培養癌細胞に対する増殖抑制作用を検定したところ、ヒト上皮鼻咽頭癌細胞(KB)、ヒト子宮頸部癌細胞(HeLa S3)、マウス白血病細胞(P388)などに強い活性を示しました。そこで次のステップとして、白血病マウスに対する動物試験(in vivo)を行ったところ、アラグステロールAは延命率(T/C)220%、アラグステロールCは延命率257%という値を示し、医薬品開発に向けて有望であることがわかりました。また小動物への毒性も低く、さらに前進することが期待されましたが、残念ながらパートナーであった製薬会社の研究方針から抗癌剤開発がはずされ、中断されたまま現在に至っております。アラグステロール類は筆者が手がけた化合物中で最も医薬品化への可能性が高いものであっただけに、このようなことになり何とも不運な天然物としか言いようがありません。
3 クラブロン類(長いつきあいとなった海産プロスタグランジン) 前述の目的(3)に最も合致する天然物としては、海洋生物由来のプロスタグランジンでありますクラブロン(clavulone)類とその関連化合物をあげることができます。この研究は旧藤沢薬品工業(現アステラス製薬)の研究グループとの共同研究として始まりました。1980年初頭に旧藤沢薬品工業の菊地博之博士および築谷康柾博士らは、沖縄県石垣島近海に生息する軟体サンゴClavularia viridisから抗炎症作用をもつ化合物を見出し、その構造解析を化学教室との共同研究として進めることになりました。 
図2 軟体サンゴClavularia viridisの写真 (沖縄県石垣島近海の水中にて撮影) 実際の仕事は筆者が担当しました。しかしなかなか構造を出すに至りませんでした。と言いますのも、現在の構造解析の主力であります2次元NMRが当時はほとんど普及していなかったためであります。約1年の間スペクトルを毎日眺めては頭をかかえていましたが、ある時、何かの拍子にこの化合物はプロスタグランジンの一種ではないかと思い当たりました。すぐにプロスタグランジンの基本構造を紙に書き、問題の化合物のスペクトルデータに合うように官能基を組み込んでいくと、無理のない素晴らしい構造式へと導かれました。当時、哺乳動物由来のプロスタグランジンの研究は世界中で活発に行われていましたし、サンゴ類にもプロスタグランジンが存在することはすでに報告されていました。しかし筆者が相手にしていた化合物はそれまで知られていたプロスタグランジンよりも酸化段階が高く、それゆえスペクトルデータはそれまでのプロスタグランジンのデータとはかなり異なっておりました。それゆえ長い間プロスタグランジンの仲間とは全く思いつきませんでした。今この化合物の構造式を見ればそんなに複雑な構造式ではありません。現在の筆者の研究室の大学院生であれば、必要なデータを手にすれば一ヶ月もかからないで正しい構造にたどりつくと思いますが、25年前の研究レベルでは1年かかってしまいました。 これらの化合物は文献に記載のない新規化合物でしたので、起源生物である軟体サンゴの学名(Clavularia viridis)にちなんでclavulone(クラブロン)と命名して専門誌に報告しました。 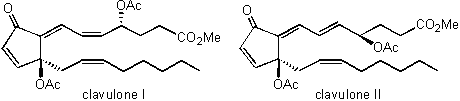 クラブロン類の生物活性としては、前述の抗炎症に加えて癌細胞増殖抑制、抗腫瘍、強心、抗菌、抗ウィルスの各作用がわかりました。とりわけ癌細胞増殖抑制作用と抗腫瘍作用は、それまでのプロスタグランジン類にはほとんど知られていなかった機能であり、福島雅典博士(当時愛知癌センター)および故本多厚博士(当時本学薬学部第一生化学教室講師)らによって研究が進められ、その作用機序としては細胞周期のG1期からS期への移行を阻害することがわかりました。しかしクラブロン類はin vivoでの安定性が悪く、この点の克服が医薬品化への課題となっています。 クラブロン類は特異な構造をもつ生物活性海産プロスタグランジンであるため、有機合成化学者の関心をよび、これまで10を超える合成研究が国内外で報告されています。最初の合成はノーベル化学賞受賞者でありますコーリー教授ら(米国ハーバード大学)が報告しました。これはラセミ体の合成でしたが、光学活性体の初めての合成は長岡博人教授(明治薬科大学)が本学化学教室に所属しておられたときに達成しました。 この海洋生物に特有なプロスタグランジンが生体内でどのような経路で合成されるのか(生合成)に興味がもたれます。この点に関して、1985年に前述のコーリー教授らは筆者が送付した軟体サンゴから粗酵素を取り出し、放射性同位体で標識化したアラキドン酸にこれを作用させた実験の結果から、クラブロン類が哺乳動物由来のプロスタグランジンとは全く異なる経路で生合成されることを提案しました。しかしこの生合成経路は詳細が証明されておらず、今後の解明が望まれています。筆者も生命科学部へシフトしてから、クラブロン類の生合成に関する研究をいくつか行いましたが、これらの研究に際しては、生命科学部の都筑幹夫教授の研究室との共同研究として進めさせていただきました。おそらくこれらの生合成研究は筆者が生命科学部に所属しなければできなかったと思っております。 軟体サンゴClavularia viridisには主成分であるクラブロン以外にも微量なプロスタグランジンが含有されていることが示唆されていたので、生命科学部に移ってからも探索研究を継続しました。その結果、クラブロン関連化合物としてトリシクロクラブロン(tricycloclavulone)とクラブバイサイクロン(clavubicyclone)を見出しました(岩島誠博士(現富山大学薬学部准教授)が当研究室に所属していたときの研究)。これらの化合物はいずれも特異な環状構造をもっていますが、クラブロンが変化して生じたものとみなすことができます。両化合物とも当研究室の伊藤久央博士(生命科学部准教授)らによって見事な方法で合成が達成されております。 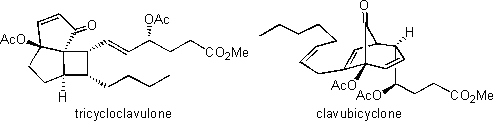 このようにクラブロン類をはじめとする海産プロスタグランジンの研究は、色々な領域と関係をもちながら発展してきました。もう25年を超えて海産プロスタグランジンとはつき合っており、筆者のライフワークのようになっています。
4 シンビジンA(30年後のリベンジ)
上述のように海洋生物の成分研究が中心でしたが、陸生植物の成分研究も手がけております。そのうちの一つを紹介いたします。筆者が山田泰司先生の化学教室に所属したいた初期の頃の大きな研究テーマとして、ラン科植物シュンラン(Cymbidium goeringii)から見出された生物活性化合物(シンビジンA、cymbidine A)の構造研究がありました。この化合物は旧藤沢薬品工業の菊地博之博士らが発見したもので、血圧降下(降圧)および利尿の作用が見出されていました。 
図3 シュンラン(Cymbidium goeringii)の写真 (本学薬草園にて渡邉謹三博士(本学薬学部教授)撮影) したがって前述の天然物探索の目的(1)に該当する化合物であります。その構造解明は旧藤沢薬品工業と化学教室との共同研究として行われました。その結果、シンビジンAは数種のアミノ酸とアミノ糖から成る化合物と推定されましたが、当時二次元NMRが普及していないこともあって構造解析は困難に直面し、中断のやむなきに至りました。しかしこのまま終ってしまってはいかにも口惜しいので、いずれチャンスがあれば研究を再開したいと思い、山田先生の了解をいただき、生命科学部の筆者の研究室の冷蔵庫に保管しました。最近になり、植物成分に興味をもつ女子院生があらわれましたので、冷蔵庫に眠っていたシンビジンAの試料について調べましたところ、奇跡的に試料が変化していないことがわかりましたので改めて研究を再開しました。当研究室に所属しておりました渡邉謹三博士(本学薬学部教授)に指導していただき、最新の機器分析および化学反応を用いて、シンビジンAのペプチドグリカンモノマー様の構造を明らかにすることができました。実に30年ぶりにリベンジをはたすことができ、胸のつかえがおりました。最近シンビジンAの合成が当研究室の伊藤博士らによって開始されており、今後の発展が期待されます。 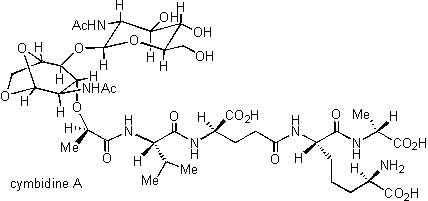
以上、3つのタイプの天然物についてお話ししました。これらの化合物以外にも紹介したい多くの天然物があるのですが、別の機会にゆずりたいと思います。筆者はこれまでの研究を通じて100種を超える新規な天然物を発見しましたが、残念ながら医薬品や農薬として実現化されたものはなく、この点で筆者の研究は成功したとは言えません。しかし題目にも書きましたように、長年の研究の中で、天然物化学の楽園で多くの天然物たちと遊ぶことができ、個人的には十分に満足できる研究生活であったと感じております。ご指導いただいた恩師の諸先生、共同研究していただいた方々、研究室のスタッフ、ならびに大学院生、学生の皆様に深謝いたします。
|
|
