 |
|
7. 研究例 |
|
7.10 TBq/mmol の H-3 ペプチドの合成とペプチドの代謝研究 |
|
| 1980 年代に入るとペプチドを医薬品として見直そうとする気運が高まってきた.代謝研究に使用するペプチド系医薬品の標識体の条件は,比放射能が高く,生物学的同等性の高いことである.
C-14は,比放射能を上げることができない(最高でも 2.2 GBq/mmol)ので失格である.また, I-125 による標識は,容易ではあるが,生物学的同等性のみならず標識の安定性に問題がある.すなわち,ペプチドの標識に使えるのは
H-3 であると結論した.ペプチド合成の煩雑さや RI廃棄物のことを考えると, [H-3]アミノ酸を原料とする方法は実際上不可能である.そこで,考えたのが標識を意図したアミノ酸残基の代わりにハロゲンや
C-C多重結合を持つアミノ酸残基を組込んだペプチド(プレカーサーペプチド)を合成しておき,これを H-3 ガスで接触還元して一挙に目的のペプチドを
H-3 標識しようとするルートである.また,構成アミノ酸残基の一部を D-アミ ノ酸に置換して特定の生理活性を増強したアナログの開発研究が盛んに行なわれているが,このようなアナログの代謝研究には,組込んだ
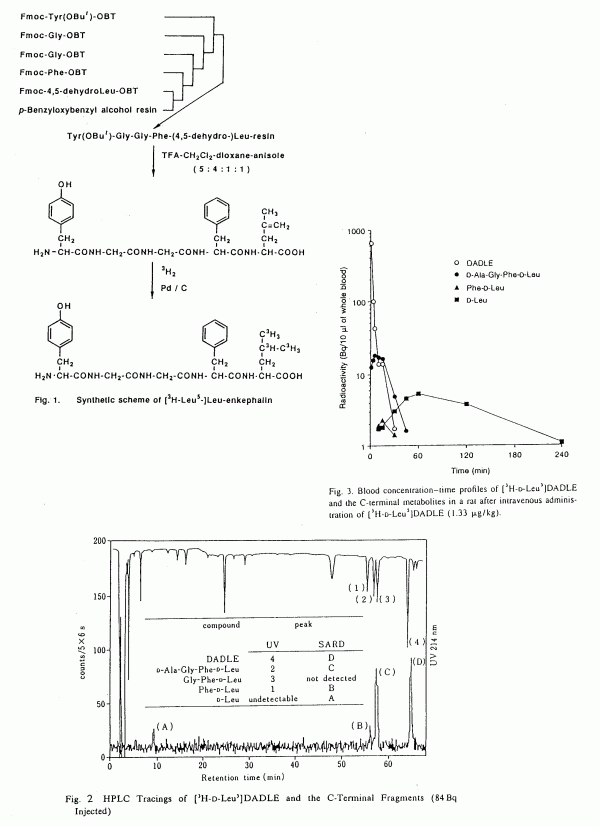
D-アミノ酸残基を H-3 標識した標識体をトレーサーとして用いるのが有効であると考えた. このようなルートで Leu-enkephalin のロイシン残基,チロシン残基,そのアナログである DALE,DADLE 等の H-3 標識体を合成した(1).ここに得られた標識体はいずれも比放射能が極めて高い(2〜5 TBq/mmol).ペプチド合成そのものは既に確立されているが,C-C多重結合や C-ハロゲン結合を温存したまま,ペプチド合成を進めてゆく条件の検討,中間段階で副生する光学異性体の分離等が苦労した問題であった.なお,チロシンを直接臭素化すると 3,5 位が臭素化される.水酸基に対してオルト位に当たるこれらの位置の H-3 標識は脱離の可能性も否定できないので,はるかに回り道になったがプレカーサーペプチドには 2,6-dibromo-4-methoxytoluene より3 工程で合成した 2,6-dibromo-Tyr を組込んだ. 一例としてLeu-enkephalin のH-3 標識ルート(2)をFig. 1に示す. 代謝研究の一例として,ラットに [H-3-D-Leu5]DADLE(4.95 TBq/mmol)を 1.33μg/kg 静注し,15 分後に採血して得られた血液をSARD つき HPLC で分析した実験結果を Fig. 2 に示す(3).図中(1)〜(4)は標品として加えた断片ペプチドに対応するピークである.Fig. 3 は各断片ペプチド濃度のタイムコースである.興味深いことは,代謝物として考えられる DADLE の 3 つのペプチド断片及びD-Leu のうち Gly-Phe-D-Leu は検出されなかったことである.このアプローチは極低投与量(μg/kg)での代謝研究を可能にしていることを強調しておく. (1) H. Hasegawa,S. Arai, Y. Shinohara, S. Baba:J. Chem.Soc. Perkin Trans. 1, 489(1993). (2) S. Baba, H. Hasegawa, Y. Shinohara: J. Labelled Compd. and Radiopharm. 27, 1359(1989). (3) H. Hasegawa, A. Nakamura, Y. Shinohara, S. Baba: J. Chromatogr. B, 287(1997). |
|
 |
|
| 章の目次へ | おわりにへ |
| Home | 略字表 |